پیچیدگیکاهشناپذیر، مانعی برای تکامل داروینیمایکل جی. بیهی/ ترجمه: عمادالدین حبیبی

طرحی از فرضیهی طراحیهوشمندانه[۱]
چارلز داروین[۲] در اثر اولیهی خود با عنوان منشا گونهها[۳]، امیدوار بود چیزی را توضیح دهد که هیچ کس پیش از آن قادر به شرح آن نبود؛ چهگونه ممکن است تنوع و پیچیدگی جهان زنده را قوانین طبیعی سادهی تولید کرده باشند. ایدهی او برای انجام این کار نظریهی تکامل[۴] از طریق انتخاب طبیعی[۵] بود. بهطور خلاصه، داروین مشاهده کرد که در تمام گونهها تنوع وجود دارد. به عنوان مثال، برخی از اعضای یک گونه از بقیه بزرگتر، برخی سریعتر و برخی دارای رنگ روشنتری هستند. او میدانست که همهی ارگانیزمهایی که به دنیا میآیند زنده نمیمانند تا تولید مثل کنند، زیرا غذای کافی برای حفظ همهی آنها وجود ندارد. داروین از اینجا استدلال کرد موجوداتی که تغییراتشان شانسی در مبارزه برای حیات به آنها میدهد، تمایل به زنده ماندن و فرزندآوری دارند. اگر این تغییرات را بتوان به ارث برد، پس با گذشت زمان ویژگیهای گونهها تغییر خواهد کرد و در طول دورههای زمانی بزرگ، شاید تغییرات گونهها در مقیاس و اندازههای بزرگتری رخ دهد.
این، ایدهای عالی بود و بسیاری از دانشمندان آن زمان به سرعت متوجه شدند که این ایده میتواند خیلی چیزها را در مورد زیستشناسی توضیح دهد. با این حال، در این که آیا این ایده میتواند تمام زیستشناسی را توجیه کند، تردیدهایی وجود داشت: اساس حیات هنوز ناشناخته باقی مانده بود. در عصر داروین، اتمها و مولکولها هنوز ساختارهایی نظری بودند؛ هیچ کس مطمئن نبود که چنین چیزهایی واقعا وجود دارند. بسیاری از دانشمندان دوران داروین، سلول را کرهی سادهی پروتوپلاسم[۶] میپنداشتند، چیزی مانند یک قطعهی میکروسکوپی از یک ژله. بدین ترتیب، اساس مولکولی پیچیدهی حیات برای داروین و معاصران او کاملا ناشناخته بود.
در صد سال گذشته، علم به چیزهای بیشتری در مورد سلول دست یافته است. بهخصوص در پنجاه سال گذشته پرده از اسرار بیشتری در مورد اساس مولکولی حیات برداشته شده است. کشف ساختار مارپیچ دورشتهای دی ان ای[۷]، کد ژنتیکی[۸]، ساختار پیچیده و نامنظم پروتیینها و اطلاعات بسیار دیگر، درک بیشتری از ساختارهای استادانهای که برای حفظ حیات لازم هستند، به ما دادهاند. در واقع، ما مشاهده کردهایم که سلول را ماشینها اداره میکنند؛ به معنای واقعی کلمه، ماشینهایی ساخته شده از مولکولها. ماشینهای مولکولیای وجود دارند که سلول را قادر به حرکت میکنند، ماشینهایی که آن را قادر به انتقال مواد غذایی میکنند و ماشینهایی که به آن اجازه میدهند تا از خود دفاع کند.
با توجه به پیشرفت عظیم حاصل از علم، از زمانی که داروین برای نخستین بار نظریهی خود را مطرح کرد، منطقی است بپرسیم که آیا این نظریه هنوز هم تبیین خوبی برای حیات به نظر میآید؟ در کتاب جعبه سیاه داروین: چالش زیستشیمیایی برای تکامل (بیهی ۱۹۹۶) [۹] من استدلال کردهام که اینطور نیست. مشکل اصلی مکانیزمهای داروینی این است که بسیاری از سیستمهای درون سلول چیزی هستند که من آن را «ترکیبات پیچیدهی کاهشناپذیر»[۱۰] مینامم. سیستم پیچیدهی کاهشناپذیر را اینگونه تعریف کردهام: سیستمی واحد که لزوما از چندین بخش که با یکدیگر به خوبی سازگار هستند و تعاملی نزدیک دارند تشکیل شدهاست. در این سیستم هر بخش به عملکرد اصلی سیستم کمک میکند و حذف هر یک از بخشها باعث میشود که سیستم بهطور موثر از عملکرد خود دست بکشد. (بیهی ۲۰۰۱) به عنوان مثالی از یک سیستم پیچیدهی کاهشناپذیر درچارچوب زندگی روزمره، من به یک تلهموش، مانند آنچه در فروشگاه ابزار آلات یافت میشود، اشاره کردهام. معمولا چنین تلههایی دارای چند بخش هستند: فنر، سکوی چوبی، چکش و قطعات دیگر. اگر کسی قطعهای را از تله جدا کند، تله دیگر قادر به گرفتن موشها نیست. بدون فنر، چکش یا قطعات دیگر، تلهای نداریم که به اندازهی نصف یا حتی یک چهارم گذشتهاش خوب کار کند؛ تلهموش شکسته اصولا کار نمیکند.
به نظر میرسد سازگاری میان سیستمهای پیچیدهی کاهشناپذیر و چهارچوب داروینی، به دلیلی که خود داروین هم بر آن اصرار داشت، بسیار دشوار است. در کتاب منشا گونهها، داروین نوشته است که «اگر بتوان نشان داد اندام پیچیدهای وجود دارد که نمیتوانسته با تغییرات متعدد، متوالی و جزیی شکل بگیرد، نظریهی من کاملا از بین خواهد رفت. اما من چنین موردی نیافتهام.» (داروین ۱۸۵۹، ۱۵۸). داروین تاکید میکرد که نظریهی او نظریهای تدریجی بوده و انتخاب طبیعی باید سیستمها را با گامهای کوچک و در طول دورهای طولانی بهبود بخشد، زیرا اگر چیزها خیلی سریع یا در گامهای بزرگ بهبود یابند، آنگاه به نظر خواهد رسید که چیزی غیر از انتخاب طبیعی در حال هدایت این فرایند است. از این رو، سخت است که ببینیم چهگونه چیزی شبیه به یک تلهموش میتواند به تدریج با چیزی شبیه به فرایند داروینی به وجود آید. به عنوان مثال، یک فنر به خودی خود یا یک سکو به خودی خود موشها را نخواهد گرفت و اضافه کردن یک قطعه به اولین قطعهی غیر عملکردی نیز یک تله نخواهد ساخت. بنابراین، به نظر میرسد که سیستمهای زیستی پیچیده و غیرقابل تقلیل مانع قابل توجهی در راه پذیرش تکامل داروینی ایجاد میکنند.
سپس این پرسش به وجود میآید که آیا سیستمی با پیچیدگی کاهشناپذیر در سلول وجود دارد؟ آیا هیچ ماشین مولکولی پیچیدهی غیرقابل تجزیهای وجود دارد؟ بله، تعداد زیادی وجود دارد. در کتاب جعبه سیاه داروین، من چندین سیستم زیستشیمیایی را به عنوان نمونههایی از پیچیدگیکاهشناپذیر مورد بحث قرار دادهام: مژک یوکاریوتی[۱۱]؛ سیستم حمل و نقل درون سلولی؛ و موارد دیگر. در اینجا من فقط بهطور خلاصه تاژک باکتریایی[۱۲] را شرح خواهم داد (دروزیه ۱۹۹۸؛ شاپیرو ۱۹۹۵) [۱۳]، زیرا با توجه به ساختار آن، میتوان دشواری تکامل داروینی را به آسانی مشاهده کرد (شکل ۱). تاژک را میتوان به عنوان یک موتور خارجی در نظر گرفت که باکتریها از آن برای شناکردن استفاده میکنند. این ساختار، اولین سازهی چرخندهی واقعی بود که در طبیعت کشف شد و شامل دم رشتهای بلندی است که به عنوان پروانه[۱۴] عمل میکند. زمانی که این تاژک به دور خود میچرخد، به محیط مایع فشار میآورد و باکتری را رو به جلو میراند.
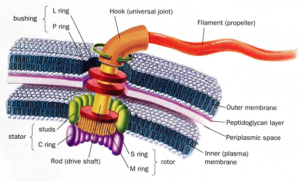
شکل ۱- تاژک باکتریایی
پروانه (تاژک) بهطور غیرمستقیم از طریق چیزی به نام منطقهی قلاب[۱۵] که به عنوان مفصل چرخده[۱۶] عمل میکند، به محور محرک[۱۷] متصل است. محور محرک به موتور متصل شده که از جریان یافتن اسید یا یونهای سدیم، از خارج سلول به داخل، برای قدرت چرخش استفاده میکند. درست همانطور که در هر قایق موتوری، موتور خارجی باید در حالی که پروانه میچرخد، ثابت نگهداشته شود، پروتیینهایی وجود دارند که به عنوان یک ساختار استاتور[۱۸] عمل میکنند تا تاژک را در جای خود نگه دارند. سایر پروتیینها به عنوان بوش[۱۹] عمل میکنند تا به محور محرک اجازهی عبور از غشای باکتریایی را بدهند. مطالعات نشان دادهاند که ۳۰ تا ۴۰ پروتیین برای تولید تاژک فعال در سلول مورد نیاز است. حدود نیمی از پروتیینها اجزای ساختار نهاییاند، در حالی که بقیه برای ساخت تاژک ضروری هستند. تقریبا در غیاب هر کدام از پروتیینها -در غیاب بخشهایی که به عنوان پروانه، محور محرک، قلاب و غیره عمل میکنند- هیچ تاژک کاربردیای ساخته نمیشود.
همانند تلهموش، مشاهدهی اینکه چهگونه فرایند تدریجی انتخاب طبیعی داروین با غربال کردن جهشهای تصادفی میتواند تاژک باکتریایی تولید کند، بسیار دشوار است زیرا قبل از اینکه عملکرد آن پدیدار شود، قطعات زیادی مورد نیاز است. یک قلاب یا یک محور محرک، به خودی خود، به عنوان ابزاری پیش برنده و محرک عمل نخواهند کرد. در واقع این وضعیت به چند دلیل بسیار بدتر از چیزی است که از این توصیف گذرا به نظر میرسد. نخست، در خصوص عملکرد تاژک، یک سیستم با کنترل پیچیده وجود دارد که به تاژک میگوید چه زمانی بچرخد، چه زمانی متوقف شود و گاهی چه زمانی خود را معکوس کند و در جهت مخالف بچرخاند. این موضوع به باکتری این امکان را میدهد که به سوی سیگنال مطلوب و یا دور از آن شنا کند، نه در یک جهت تصادفی که خیلی راحتتر میتواند سمت آن را اشتباه بگیرد. بنابراین، مشکل محاسبهی منشا تاژک به خود تاژک محدود نمیشود بلکه به سیستمهای کنترلی مرتبط نیز گسترش مییابد.
دوم، مشکل ظریفتر این است که چهگونه قطعات خود را در یک مجموعه گرد هم میآورند. قیاس با یک موتور خارجی از یک لحاظ با شکست مواجه میشود: یک موتور برونبرد معمولا تحت هدایت یک انسان مونتاژ میشود؛ عاملی هوشمند که میتواند مشخص کند کدام قسمتها به کدام بخشهای دیگر متصل هستند. با این حال، اطلاعات مونتاژ یک تاژک باکتریایی، (یا در واقع، هر ماشین زیست مولکولی دیگر) در اجزای پروتیینی خود ساختار وجود دارد. فعالیت تحقیقاتی تازهای نشان میدهد که فرایند مونتاژ برای یک تاژک به حد زیادی ظریف و پیچیده است (یونکورا و همکاران ۲۰۰۰). اگر آن اطلاعات مونتاژ از پروتیینها وجود نداشته باشد، در این صورت هیچ تاژکی تولید نمیشود. بنابراین، حتی اگر ما یک سلول فرضی داشته باشیم که در آن پروتیینهایی حضور داشتند که با تمام بخشهای تاژک هومولوگ[۲۰] (همسان) باشند (همسان در حد انجام کارهایی شاید به غیر از نیروی محرکه) اما اطلاعات مربوط به چهگونگی مونتاژ شدن خودشان به تاژک را نداشته باشند، هنوز قادر به بهدست آوردن ساختار نیستیم و مشکل کاهشناپذیری همچنان باقی خواهد ماند.
به دلیل چنین ملاحظاتی من به این نتیجه رسیدم که فرایندهای داروینی توضیحات امیدوارکنندهای برای بسیاری از سیستمهای زیستشیمیایی در سلول نیستند. در عوض، من اشاره کردهام که اگر کسی به تعاملات اجزای تاژک، مژک یا دیگر سیستمهای سلولی پیچیده و کاهشناپذیر نگاه کند، به نظر میرسد آنها را عاملی هوشمند عامدانه طراحی کرده است. ویژگیهای سیستمهایی که طراحی را نشان میدهند همانهایی هستند که در توضیحات داروینی مانع ایجاد میکنند: «تعامل خاص اجزای متعدد برای انجام یک عملکرد که فراتر از اجزای فردی است.» برای طراحی ساختار منطقی یک استدلال، قیاسی ساده نیاز است: هر زمان که چنین فعل و انفعالات بسیار خاصی را در دنیای روزمره خود میبینیم، چه در یک تلهموش و چه در جای دیگر، بهطور قطع متوجه میشویم که سیستمها به صورت عمدی مرتب شدهاند؛ یعنی فاعل هوشمندی به شکلی هدفمند آنها را طراحی کرده است. حالا ما سیستمهایی با پیچیدگی مشابه را در سلول مییابیم. از آنجا که هیچ توضیح دیگری با موفقیت به آنها نپرداخته است، من استدلال میکنم که ما باید استقرا را گسترش و تعمیم دهیم تا ماشینهای مولکولی را در بر گیرد، یعنی فرض را بر این بگیریم که آنها به شکلی هدفمند طراحی شدهاند.
تصورات نادرست در خصوص پیامدهای فرضیهی طراحی
فرضیهی طراحیهوشمندانه عمدتا به دلیل تاثیرات و اشارات فلسفی و الهیاتی آن، بسیار بحثبرانگیز است. در سالهای پس از انتشار جعبه سیاه داروین، تعدادی از دانشمندان و فلاسفه تلاش کردهاند استدلال اصلی آن را تکذیب کنند. من این تکذیبات را در بهترین حالت غیرمتقاعدکننده مییابم و دقیقا برعکس، فکر میکنم برخی مثالهای متقابل قلمداد شده برای طراحیهوشمندانهانه، بهطور ناخواستهای آموزنده است. این نمونهها نه تنها کفایت انتخاب طبیعی را برنمیتابند، بلکه به وضوح مانعی را نشان میدهند که پیچیدگیکاهشناپذیر را به داروینیسم تحمیل میکند. این مثالها همچنین نشان میدهند کسانی که نظریهی داروین را باور دارند، در تشخیص مشکلات نظریهی خود مشکل بزرگی دارند. در ادامه دو نمونهی متقابل از این مثال نقض را با جزییات بررسی خواهم کرد. با این حال، قبل از اینکه این کار را انجام دهم، ابتدا به چند اشتباه رایج که بحث طراحی زیستشیمیایی را احاطه کردهاند، اشاره خواهم داشت.
اول از همه، مهم است درک کنیم که یک فرضیهی طراحیهوشمندانه به خودی خود با تکامل در تضاد نیست – یعنی، «تکامل» به سادگی به عنوان انتقال همراه با تغییر و تحول درک میشود، اما مکانیزم آن مشخص نیست. به هر حال، یک طراح ممکن است انتخاب کرده باشد که به این روش کار کند. تمرکز طراحیهوشمندانه، به جای انتقال متعارف، بر «مکانیزم» تکامل صورت میگیرد؛ یعنی چهگونه همهی این اتفاقات رخ میدهد؟ با انتخاب طبیعی یا با طراحیهوشمندانه هدفمند؟
نکته دومی که اغلب نادیده گرفته میشود اما باید مورد تاکید قرار گیرد این است که طراحیهوشمندانه میتواند به راحتی همراه با درجهی بالایی از انتخاب طبیعی وجود داشته باشد. در واقع، ممکن است مقاومت آنتیبیوتیک و آفتکش، پروتیینهای ضد یخزدگی در ماهیها و گیاهان و موارد بیشتر دیگری با مکانیزم داروینی توضیح داده شوند اما ادعای مهم نظریهی طراحیهوشمندانه این نیست که انتخاب طبیعی هیچ چیزی را توضیح نمیدهد، بلکه ادعا این است که همه چیز را توضیح نمیدهد.
کتاب من، جعبه سیاه داروین، که در آن استدلال طراحی را با جزییات کامل شرح میدهم، بهطور گستردهای در بسیاری از نشریات مورد بحث قرار گرفتهاست. گرچه موضوعات بسیاری مطرح شدهاست، من فکر میکنم واکنش کلی دانشمندان به بحث طراحی به خوبی و بهطور مختصر در کتاب اخیر راه سلول[۲۱]، که انتشارات دانشگاه آکسفورد[۲۲] آن را منتشر کرده، خلاصه شدهاست. کتاب را زیستشیمیدان دانشگاه ایالتی کلرادو[۲۳]، فرانکلین هارولد[۲۴]، نوشته است. او با اشاره به کتاب من مینویسد: «ما باید به عنوان یک اصل، جایگزینی طراحیهوشمندانه را در بحث راجع به شانس و ضرورت رد کنیم (Behe ۱۹۹۶). اما باید قبول کنیم که هیچ شرح دقیقی از تکامل سیستم زیستشیمیایی داروینی وجود ندارد و تنها مجموعهای از گمانهزنیهای آرزومندانه ارایه شده است.» (هارولد ۲۰۰۱، ۲۰۵).
اجازه دهید به ترتیب معکوس، دو نکتهی هارولد را تاکید کنم. نخست این که هارولد مانند دیگر خوانندگان کتاب من که بازنگری خود را انجام دادهاند[۱]، تصدیق میکند که داروینیسم هیچ گونه توضیح واقعی برای پیچیدگی زیاد سلول ندارد و تنها گمانهزنیهای بدون پشتوانه و بیاثر است که بهطور محاورهای به عنوان «روایتهای درست و حسابی» شناخته میشوند. من شش سال پیش در کتاب جعبه سیاه داروین، اساسا همین ادعا را کرده بودم و با مقاومت شدیدی مواجه شدم؛ بیشتر از طرف طرفداران اینترنتی داروینیسم که ادعا میکردند صدها یا هزاران مقالهی تحقیقاتی وجود دارد که تکامل داروینی سیستمهای زیستشیمیایی پیچیده و غیرقابلکاهش را تبیین میکنند، آنو ها وبسایتهایی برای مستند کردن ادعایشان ایجاد کردند [۲].
به عنوان یک پاسخ کافی به این ادعاها، من تنها به اظهارات هارولد و همچنین به دیگر منتقدانی که موافق اند توضیحات داروینی کمبود دارد، تکیه میکنم. به هر حال، اگر دانشمندان برجستهای که طرفدار نظریهی طراحیهوشمندانه نیستند سر این مورد توافق کنند که خود سیستمها بدون توضیح باقی میمانند و نمیتوان آنها را تحت تاثیر متغیر مستقلی قرار داد، آنگاه میتوان به این بحث و جدل خاتمه بخشید. ضمنا بگذارید برای اشاره به نکتهای این بحث را لحظهای متوقف کنیم. برای نظریهای که به مدتی طولانی بر دانش زیستشناسی تسلط داشته است؛ من این را پذیرشی شگفتآور مییابم. نظریهی داروینی، علیرغم سلطنت طولانی مدتش به عنوان نظریهی بنیادین زیستشناسی، چنان ثمرهی کمی در توضیحِ پایه و اساس مولکولی حیات داشته که در اثبات کفایتِ چارچوب خود برای درک و فهم منشا و پیچیدگی حیات به شدت ناتوان مانده است.
نکتهی دوم هارولد این است که به نظر می رسد او بر این باور است که گویا اصلی وجود دارد که ما را از تحقیق و بررسی دربارهی طراحیهوشمندانه منع میکند. در حالی که طراحی ایدهی واضحی است که وقتی شما تصویری ترسیم شده از تاژک یا دیگر سیستمهای پیچیدهی زیستشیمیایی میبینید (شکل۱) فورا در ذهنتان پدیدار میشود. اما این چه اصلی است؟ او هیچگاه این موضوع را بهطور واضح بیان نمیکند. من فکر میکنم این اصل به این نکته خلاصه میشود: طراحی به نظر میرسد به شدت فراتر از طبیعت را نشان دهد. این موضوع که نظریهی طراحیهوشمندانه مفاهیم فلسفی و الهیاتی را در خود جای داده است، بسیاری از مردم را ناراحت میکند زیرا آنها فکر میکنند علم نباید به نظریهای که به فراتر از طبیعت اشاره میکند، بپردازد.
من با این نوع نگاه کاملا مخالفم و آن را بزدلانه میدانم. من فکر میکنم که علم باید شواهد و مدارک را به هر جایی که منتهی میشود، دنبال کند. این تنها راه برای پیشرفت است. به عنوان مثال، به گفتهی زیستشناس دانشگاه آکسفورد، ریچارد داوکینز[۲۵]، «داروین این امکان را به وجود آورد که بتوان روشن فکر آتئیست شد.» (داوکینز ۱۹۸۶.۶) کِنِث میلر[۲۶] هم که کمی کمتر مشهور بود نوشته است: «]خدا[ تکامل را به عنوان ابزاری استفاده کرد تا ما را آزاد کند» (میلر ۱۹۹۹.۲۵۳). استوارت کافمن، نظریه پرداز برجسته پیچیدگی، این چنین میپندارد که نظریهی داروین قادر نیست تمام زیستشناسی را توضیح دهد: «نظریهی داروین کافی نیست . . . انتخاب طبیعی نمیتواند تنها مرجع و منبع نظمی باشد که ما در این جهان مشاهده میکنیم» (کافمن ۱۹۹۵.viii)[۲۷]. کافمن فکر میکند نظریهاش به گونهای نشان خواهد داد که ما «به جهان وابسته هستیم.» مقصود این است که تمام نظریههای مربوط به منشا حیات مفاهیمی فلسفی و الهیاتی را با خود حمل میکنند و در مسیر توضیحی برای حیات، راهی برای اجتناب از آنها وجود ندارد.
پرسش دیگری که برخی را ناراحت میکند این است که چهگونه سیستمهای زیستشیمیایی توانستهاند طراحی شوند؟ سوء برداشت رایج این است که سیستمهای طراحی شده باید از صفر و از تودهای دود ساخته شوند. اما لزوما چنین چیزی درست نیست. فرایند طراحی ممکن است بسیار ظریفتر بوده باشد. در واقع، ممکن است به هیچ وجه قوانین طبیعی را نقض نکرده باشد. بیایید در کل یک احتمال را درنظر بگیریم. فرض را بر این میگیریم که طراح، همانطور که اکثر مردم حدس میزنند، قطعا خدا است. کِنِث میلر در کتاب خود با عنوان در جستوجوی خدای داروین مینویسد:
ماهیت نامشخص رویدادهای کوانتومی، به خدایی با هوش و با ظرافت اجازه میدهد که این رویدادها را به روشهای عمیقی بدون اینکه از لحاظ علمی قابل کشف و ردیابی باشند، تحت تاثیر قرار دهد. این رویدادها و اتفاقها ممکن است بتوانند پدیدار شدن یک جهش ژنتیکی را شامل شوند . . . یا حتی بقای سلولها و ارگانیسمهای منفرد را که تحت تاثیر فرآیندهای تصادفی واپاشیهای پرتوزا قرار میگیرند، شامل شوند. (میلر ۱۹۹۹.۲۴۱)
گرچه میلر فکر نمیکند که هدایت در تکامل ضروری باشد، اما اگر چنین باشد (که باور من به شخصه این است)، آنگاه یک مسیر برای یک خدای با ظرافت برای طراحی حیات، بدون نقض قوانین طبیعت، باز میشود. اگر اتفاقات کوانتومی مانند واپاشی تصادفی رادیواکتیو در اثر قوانین علّی اداره نشوند، در این صورت مداخله در چنین اتفاقاتی قانون طبیعت را نقض نمیکند. به عنوان یک خدا باور همچون میلر، این امر برای من بهطور کاملا ممکن به نظر میآید. با این حال، باید اضافه کنم که چنین فرایندی باعث طراحیهوشمندانه و نه تکامل داروینی، خواهد شد. افزون بر این، اگرچه ممکن است نتوانیم مداخلات کوانتومی را تشخیص دهیم اما ممکن است به اطمینان برسیم که ساختار نهایی به صورتِ طراحی شده است.
تصورهای اشتباه دربارهی راههای فرضی برای عبور از غیرقابل کاهش بودن سیستمهای زیستشیمیایی
یک مثال فرضی را در نظر بگیرید که در آن پروتیینهای هومولوگ به تمامی اجزای یک ماشین مولکولی بهطور غیرقابل کاهش، در ابتدا کارایی فردی دیگری در داخل سلول داشته باشند. آیا در این صورت ممکن است همانطور که برخی از داروینیستها پیشنهاد دادهاند، سیستم کاهشناپذیر، از واحد و اجزایی تشکیل شده باشد که در ابتدا بهطور مجزا عمل میکردند؟
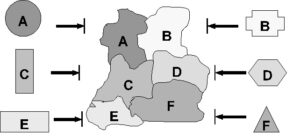
شکل۲: اجزای یک ماشین مولکولی کاهشناپذیر باید سطوحی داشته باشند که بهطور دقیق با یکدیگر مطابقت داشته باشند تا اتصالهای خاصی را امکانپذیر سازند. این نقاشی تاکید میکند که حتی اگر پروتیینهای بهطور مجزا عملکننده که به اجزای یک ساختار پیچیده هومولوگ هستند، ابتدا کارایی جداگانهای داشته باشند، سطوح آنها با یکدیگر مکمل نخواهد بود. بدینگونه، حتی اگر اجزای مجزا ابتدا کارایی فردی داشته باشند، مشکل عدم کاهشپذیری همچنان باقی میماند. (پیکانهای مسدود نشاندهندهی این است که شکلهای اصلی پروتیینها مناسب برای اتصال به سایر پروتیینها در ماشین مولکولی نیستند.)
متاسفانه این تصویر، همانطور که من در جعبه سیاه داروین بحث کردهام، مشکل را به طرز بسیار زیادی سادهتر از آنچه هست نشان میدهد. (بیهی ۱۹۹۶، ص ۵۳) در اینجا تشابهها با تلهموش تا حدی شکست میخورند، زیرا اجزای یک سیستم مولکولی باید بهطور خودکار یکدیگر را درون سلول پیدا کنند. آنها نمیتوانند مانند یک تلهموش به کمک یک عامل هوشمند مرتب شوند. برای پیدا کردن یکدیگر در داخل سلول، اجزای تعاملی باید سطوح خود را بهگونهای شکل دهند که بهطور بسیار دقیق با یکدیگر مطابقت داشته باشند؛ مانند تصویر شکل ۲. در ابتدا اما، اجزایی که به صورت مجزا عمل میکردند، سطوح مکمل یکدیگر را نداشتند. بنابراین، باید ابتدا تمام سطوح تعاملی همهی اجزا به گونهای تنظیم شوند که قادر به همکاری با یکدیگر باشند. تنها پس از آن کاربرد جدید است که سیستم ترکیبی پدیدار خواهد شد. به این ترتیب، تاکید میکنم که «مشکل عدم کاهشپذیری باز هم باقی میماند، حتی اگر پروتیینهای تکی، که به اجزای سیستم مشابه هستند، در ابتدا کارایی جداگانه داشته باشند».
نکتهی دیگری که باید در نظر داشته باشیم، توجه به این موضوع است که برخی سیستمها با اجزای اضافی یا زاید ممکن است «هستهای» پیچیده و کاهشناپذیر داشته باشند. به عنوان مثال، یک خودرو با چهار شمع موتور ممکن است با سه یا حتی دو شمع موتور هم کار کند، اما مسلما بدون هیچ یک نمیتواند کار کند. تلههای موش اغلب دارای دو فنر هستند تا به آنها قدرت اضافی بدهند. در صورتی که یکی از فنرها حذف شود، تله همچنان میتواند کار کند اما اگر هر دو فنر حذف شوند، قادر به کار نخواهد بود. به همین ترتیب، در تلاش برای تصور منشا تلهموش به وسیلهی مکانیزمهای داروینی، همچنان با تمام مشکلاتی که با تلهموش داشتیم، مواجه هستیم. مثالی دیگر از افزونگی در سطح سلولی، ساختار بسیار پیچیدهای به نام مژک یوکاریوتی[۲۸] است که حاوی حدود ۲۵۰ پروتیین متمایز است (داچر[۲۹]، ۱۹۹۵). این ساختار نسخههای متعددی از تعدادی اجزا دارد، از جمله میکروتوبولها[۳۰] و بازوهای داینئین[۳۱]. با این حال، برای کارکرد درست مژک، وجود حداقل یک نسخه از هر جزء ضروری است، همانطور که من در کتابم به تصویر کشیدهام (به ۱۹۹۶ ص۶۰). بنابراین، مانند تلهموش، تجسم تولید تدریجی آن از طریق مکانیزمهای داروینی همچنان سخت به نظر میرسد. کنث میلر به افزونگی در مژک به عنوان مثالی مخالفِ ادعای من دربارهی عدم کاهشپذیری آن اشاره کرده است (میلر ۱۹۹۹ ص۱۴۰-۱۴۳)، اما افزونگی تنها موجب تاخیر در مسئلهی عدم کاهشپذیری میشود و آن را نمیتواند از بین ببرد.
برخی از داروینیستها به جای نشان دادن اینکه نظریهشان چهگونه میتواند برخورد با مانع را مدیریت کند، به امید دور زدن پیچیدگی کاهشناپذیر، در حال انجام رقص کلامی هستند. در یک بحث بین حامیان و مخالفان طراحیهوشمندانه که موزهی تاریخ طبیعی آمریکا در آوریل ۲۰۰۲ آن را برگزار کرد، کنث میلر در واقع ادعا کرد که تلهموش کاهشناپذیر نیست، به دلیل اینکه زیرمجموعههای تلهموش و حتی هر قطعهی فردی آن، میتوانند همچنان بهطور «کارکردی» به تنهایی عمل کنند. میلر توجه داشت که میلهی نگهدارندهی تلهموش میتواند به عنوان یک خلال دندان استفاده شود، بنابراین همچنان یک «کارکرد» خارج از تلهموش را دارد. او ادامه داد که هر یک از اجزای تله میتواند به عنوان یک وزنهی نگه دارندهی کاغذ مورد استفاده قرار گیرند، بنابراین همهی آنها «کارکردهایی» دارند. از آنجا که هر جسمی که جرم داشته باشد میتواند به عنوان یک وزنهی کاغذ استفاده شود، پس هر قسمتی از هر چیزی کارکرد خود را دارد. بدین ترتیب ناگهان ایدهی پیچیدگیکاهشناپذیر از بین میرود! به این ترتیب، مشکل حاد برای درک آرامشطلبانه از طریق گام بهگام که هر کودکی میتواند در سیستمهایی مانند تلهموش ببیند، به طرزی روان وارد تبیین شده است.
البته که توضیح ساده بر پایهی یک اشتباه شفاف و یک ابهام وقیحانه است. میلر در واقع از واژه «کارکرد» در دو مفهوم متفاوت استفاده میکند. به خاطر داشته باشید که تعریف پیچیدگیکاهشناپذیر به این نکته اشاره دارد که حذف یک قسمت «سبب میشود که سیستم بهطور موثر کار نکند». میلر در تبیین خود، بدون اینکه به وضوح این موضوع را بیان کند، توجهش را از کارکرد جداگانهی سیستم دستنخورده به این پرسش که آیا میتوانیم کاربرد متفاوتی برای برخی قطعات پیدا کنیم منتقل میکند. با این حال، اگر یک قسمت از تلهموشی که من نشان دادهام حذف شود، دیگر نمیتواند موشی را بگیرد. در واقع، سیستم به طور موثر کار نمیکند، بنابراین، سیستم، همانطور که من نوشته بودم، بهطور کاهشناپذیر پیچیده است. افزون بر این، کارکردهایی که میلر بهطور آسان به قطعات نسبت میدهد -مثلا وزنهی کاغذ، خلال دندان، یا دسته کلید- یا اساسا با سیستم موشگیری مرتبط نیستند (بر خلاف مجموعه تلههای موشگیریای که جان مکدونالد[۳۲] ارایه داده است و در ادامه به آنها خواهم پرداخت) یا ارتباط کمی دارند. بنابراین، در این باره که چهگونه کارکرد سیستم به تدریج ایجاد شده است، سرنخی به دست ما نمیدهد. در واقع میلر چیزی را با دقت توضیح نداده است.
با پشت سر گذاشتن مسئلهی تلهموش، میلر سراغ تاژک باکتری رفته و دوباره به همان اشتباه پناه میبرد. اگر چیز دیگری نباشد، باید قدرت نفسگیر جرات کلامی او را تحسین کرد که تلاش میکند تا معضل به شدت دشواری را برای داروینیسم به مزیتی تبدیل کند. در سالهای اخیر نشان داده شده که تاژک باکتریایی سیستمی پیچیدهتر از چیزی است که فکر میشده است. نه تنها این اندامک به عنوان یک دستگاه پیشران دوار[۳۳] عمل میکند، همچنین درون خود مکانیزم ظریفی از داخل سلول به خارج برای انتقال پروتیینهایی که بخش خارجی این دستگاه را تشکیل میدهند، دارد. (Aizawa 1996) بدون شک، میلر ادعا کرد که تاژک به دلیل اینکه برخی پروتیینهای آن ممکن است از دست بروند و بقیه همچنان میتوانند پروتیینها را انتقال دهند، شاید بهطور مستقل غیرکاهشپذیر نباشد. (پروتیینهای مشابه -اما نه دقیق- با برخی از باکتریها در سیستم ترشحی نوع سوم[۳۴] وجود دارند. برای اطلاعات بیشتر، به مقالهی هوک/ ۱۹۹۸ مراجعه کنید) [۳۵]. او باز هم از همان اشتباه ابهامزا استفاده میکند و تمرکز را از کارکرد سیستم به عنوان یک دستگاه پیشران دوار، به قابلیت یک زیرمجموعه از سیستم برای انتقال پروتیینها از طریق یک غشا منتقل میکند. با این حال، حذف قسمتهای تاژک باکتری بدون شک توانایی سیستم را به عنوان یک دستگاه پیشران دوار را از بین میبرد. بنابراین، با وجود مخالفت میلر، تاژک باکتری در واقعیت غیرکاهشپذیر است. افزون بر این، کارکرد انتقال پروتیین ها کمتر یا تقریبا هیچ ارتباطی با کارکرد پیشرانی دوار ندارد، چنانچه کارکرد یک خلال دندان با تلهموش ارتباطی با یکدیگر ندارند. بنابرین کشف کارکرد پروتیینهای حامل به ما هیچ چیز دربارهی اینکه چهگونه فرایندهای داروینی ممکن است دستگاه پیشران چرخشی ایجاد کنند، نمیگوید.
زنجیرهی انعقاد خون
پس از برخورد با چند سوءبرداشت متداول دربارهی طراحیهوشمندانه، در بخشهای پیش رو به بررسی دو سیستم میپردازم که به عنوان مثالهایی مهم برای ادعاهای من دربارهی پیچیدگیکاهشناپذیر مطرح شدهاند. من نه تنها نشان میدهم که این موارد به نقص و شکست میانجامند، بلکه همچنین نشان میدهم چهگونه این موارد جدیت مسئلهی پیچیدگیغیرکاهشپذیر را بیش از پیش بیان میکنند.
در جعبه سیاه داروین، بررسی کردهام که زنجیرهی انعقاد خون[۳۶]، نمونهای از یک سیستم کاهشناپذیر است (بیهی ۱۹۹۶. ۷۴-۹۷). به نظر میآید انعقاد فرایند سادهای است که میتوان به سادگی آن را با چشم مشاهده کرد. یک برش کوچک یا یک زخم کوچک ممکن است مدتی خونریزی داشته باشد و سپس آهسته آهسته کم شود و در نهایت با تشکیل لختهی خونِ قابلمشاهده متوقف شود. با این حال، تحقیقات انجام شده در پنجاه سال اخیر نشان دادهاند که این سادگی ظاهری را سیستمی با پیچیدگی فوقالعاده پشتیبانی میکند (هالکیِر[۳۷] 1992). بهطورکلی، در سیستم انعقاد خون مهرهداران، بیش از بیست قطعهی پروتیینی جداگانه دخیل هستند. هماهنگی عمل این اجزا به ایجاد ساختاری شبکهای و تارمانند در محل برش منجر میشود که سلولهای قرمز خون را به دام میاندازد و خونریزی را متوقف میکند. در واقع، بیشتر اجزای زنجیرهی انعقاد خون در ساختار لختهی خون وجود ندارند، بلکه در کنترل زمانبندی و مکانیابی لخته تاثیر دارند. به هر حال، منطقی نیست که لخته در زمانها و مکانهای نامناسبی ایجاد شود. یک لخته که در مکان اشتباهی مثل قلب یا مغز شکل گیرد ممکن است به حملهی قلبی یا سکتهی مغزی منجر شود. حتی اگر لخته در مکان مناسبی ایجاد اما به آرامی انجام شود، کارایی چندانی نخواهد داشت.
الیاف شبکهای نامحلول لخته، خود از پروتیینی به نام فیبرین[۳۸] تشکیل شدهاند. با این حال، شبکهای از الیاف نامحلول میتواند قبل از وقوع برش یا زخم جریان خون را مسدود کند. بنابراین، فیبرین ابتدا به شکلی حل شونده و غیرفعال به نام فیبرینوژن[۳۹] در جریان خون وجود دارد. وقتی سیستم بستهی گردش خون دچار آسیب، گسستگی یا نفوذ میشود، فیبرینوژن با برش یک قطعه از انتهای دو پروتیین از سه پروتیینی که آن را تشکیل میدهند، فعال میشود. این اقدام نقاطی چسبنده روی پروتیین آشکار میکند که اجازه میدهد به یکدیگر متصل شوند و تجمع یابند. به دلیل شکل فیبرین، مولکولها به شکل الیاف بلندی تجمع میکنند که ساختار شبکهای لخته را تشکیل میدهند. در نهایت، زمانی که بهبودی اتفاق میافتد، لخته به کمک آنزیمی به نام پلاسمین[۴۰] برداشته میشود.
آنزیمی که فیبرینوژن را به فیبرین تبدیل میکند، با نام ترومبین[۴۱] شناخته میشود. با این حال، عمل ترومبین نیز باید به دقت کنترل شود. اگر چنین نباشد، ترومبین به سرعت فیبرینوژن را به فیبرین تبدیل میکند و منجر به تشکیل لختههای خون بزرگ و مرگ سریع میشود. ترومبین به شکلی نامحلول به نام پروترومبین[۴۲] وجود دارد که باید به کمک مولفهی دیگری به نام فاکتور استوارت [۴۳]فعال شود. اما باز هم به همان دلیل، فعالیت فاکتور استوارت هم باید کنترل شود و این فاکتور به کمک مولفهی دیگری فعال میشود. در نهایت، مولفهای که معمولا این زنجیره را آغاز میکند، فاکتور بافتی[۴۴] است. این فاکتور در سلولهایی قرار دارد که بهطور معمول با سیستم گردش خون در تماس نیستند. با این حال، هنگام وقوع زخم، خون در تماس با فاکتور بافت قرار میگیرد که این موضوع زنجیرهی لخته شدن را آغاز میکند.
در نتیجه، در زنجیرهی انعقاد خون، یک مولفه بر مولفهی دیگری عمل میکند، سپس به مولفهی بعدی اثر میگذارد و همینطور ادامه مییابد. من ادعا کردهام که این زنجیره از دیدگاه پیچیدگی، کاهشناپذیر است، زیرا اگر یک مولفه حذف شود، مسیر یا فورا فعال میشود یا بهطور دایم غیرفعال میشود. نمیتوانستیم فرض کنیم که این مسیر از نقطهی فیبرینوژن آغاز شده و مولفهها به تدریج اضافه شدهاند، زیرا فیبرینوژن به تنهایی کاربردی ندارد. همچنین این استدلال منطقی نیست که حتی با چیزی شبیه به فیبرینوژن و یک آنزیم غیراختصاصی[۴۵] (ترومبین یک آنزیم اختصاصی نیست و بر چندین سوبسترای[۴۶] دیگر هم عمل میکند) که ممکن است آن را جدا کند شروع کنیم، زیرا لخته شدن به گونهای نیست که کنترل شود و احتمالا بیش از سود آسیب به همراه خواهد داشت.
راسل دولیتل[۴۷]، زیستشیمیدان برجسته در حوزهی پروتیینها، استاد زیستشیمی در دانشگاه کالیفرنیا[۴۸]، عضو آکادمی ملی علوم و دانشجوی مادامالعمر در زمینهی سیستم انعقاد خون، با من مخالفت کرد. به عنوان بخشی از یک گردهمایی که در آن کتاب من و کتاب صعود به قلهی نامحتمل[۴۹]، نوشتهی ریچارد داوکینز، در مجلهی بوستون ریویو[۵۰] مورد بحث و بررسی قرار گرفت، دولیتل مقالهای در مورد پدیدهی تکثیر ژنی نوشت که بر اساس آن سلول ممکن است کپیای اضافی از یک ژن فعال را دریافت کند. سپس او گمان کرد که بسیاری از اجزای مسیر انعقاد خون، ساختارهای مشابهی به یکدیگر دارند که از طریق تکثیر ژن و تفاوتهای تدریجی پدید آمدهاند. این دیدگاهی متداول در میان داروینیستها است. پروفسور دولیتل به توصیف تجربهای پرداخت که به نظر او نشان میدهد این زنجیره در واقع کاهشناپذیر نیست. او به مقالهای از بوگه[۵۱] و همکاران(۱۹۹۶ ( a با عنوان «از دست دادن فیبرینوژن موشها را از اثرات پلیوتروپیک[۵۲] کمبود پلاسمینوژن [۵۳]نجات میدهد»[۵۴] ارجاع داد. او در این مقاله مینویسد:
به تازگی ژن پلامینوژن از موشها حذف شد و همانطور که پیشبینی میشد، این موشها مشکل لختهشدن پیدا کردند، زیرا لختههای فیبرینی نمیتوانستند از بین بروند. مدتی بعد همان محققان، ژن فیبرینوژن را در نسل دیگری از موشها حذف کردند. بار دیگر، بهطور قابل پیشبینی، این موشها به مشکلات لختهای دچار شدند، اگرچه در این مورد مشکل خونریزی بود. فکر میکنید وقتی که این دو گونه موش با هم آمیزش کردند چه اتفاقی افتاد؟ در واقع، موشهایی که هر دو ژن را از دست داده بودند، عادی بودند! بر خلاف ادعاهای پیچیدگیکاهشناپذیر، تمام مجموعه پروتیینها لازم نیست. موسیقی و هارمونی میتواند از یک ارکستر کوچکتر نیز به وجود بیاید. (دولیتل ۱۹۹۷)
بار دیگر یادآوری میکنم که فیبرینوژن پیشساز مادهی لختهی خون است. پلاسمینوژن هم پیشساز پلاسمین است که لختههای خون را پس از انجام وظیفهشان برطرف میکند. بنابراین، اگر یکی از این ژنهای مسیر لختهیخون را حذف کنید، نتیجه مشکلساز خواهد بود اما دولیتل ادعا کرد که اگر هر دو را حذف کنید، آنگاه سیستم به ظاهر دوباره کارآمد خواهد بود. این نتیجهای جالب اما به وضوح نادرست است. دولیتل مقاله را اشتباه خوانده بود.
چکیدهی مقاله بوگه و همکاران (۱۹۹۶) بیان میکند که «موشهایی که کمبود پلاسمینوژن و فیبرینوژن دارند از نظر ظاهری با موشهایی که کمبود فیبرینوژن دارند قابل تشخیص نیستند». به عبارت دیگر، مشکلات موشهایی که به طور مضاعف جهش یافتهاند، مشابه مشکلات موشهایی است که فقط کمبود پلاسمینوژن دارند. این مشکلات شامل عدم توانایی لختهشدن، هموراژی[۵۵] (خونریزی) و مرگ جنس ماده در طول بارداری است. کمبود پلاسمینوژن منجر به مجموعه علایم دیگری میشود: ترومبوز[۵۶]، زخمهایی در سطح مخاط و زیر مخاط دستگاه گوارش و حد بالای مرگ و میر. موشهایی که فاقد هر دو ژن از عوارض نامطلوب کمبود پلاسمینوژن «نجات» یافتند تنها از مشکلات مربوط به کمبود فیبرینوژن رنج میبردند[۳]. دلیل این امر آسان است. وجود پلاسمینوژن برای برطرف کردن لختههای خون -که در صورت باقی ماندن با عملکردهای طبیعی تداخل دارند- لازم است. با این حال، اگر ژن فیبرینوژن هم حذف شود، آنگاه لختههای خون از همان ابتدا نمیتوانند شکل بگیرند و حذف آنها مشکلی نخواهد بود. با این حال، اگر لختههای خون نتوانند شکل بگیرند، سپس هیچ سامانهی انعقاد خون کارآمدی وجود نخواهد داشت و موشها رنج عواقب قابل پیشبینی را تحمل خواهند کرد.
جدول۱. اثرات از بین بردن ژن برای اجزای لخته شدن خون
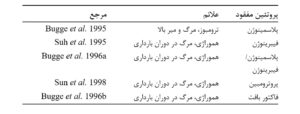
بیگمان، موشهایی که جهش دوگانه یافتهاند (دارای حذف همزمان پلاسمینوژن و فیبرینوژن هستند) به عنوان موشهایی عادی شناخته نمیشوند و نمیتوانند مثالهای معتبری برای فرایند تکامل باشند.
گروهی که موشهایی فاقد پلاسمینوژن و فیبرینوژن تولید کردهاند، همچنین موشهایی را که بهطور جداگانه از سایر اجزای زنجیرهی انعقاد خون محروم هستند، نیز تولید کردهاند؛ از جمله، پروترومبین و فاکتور بافت. در هر مورد، موشها به شدت آسیب میبینند. این دقیقا همان چیزی است که اگر زنجیرهی انعقاد خون بهطور کاهشناپذیری پیچیده باشد توقع میرود (جدول ۱ را ببینید).
از این رویداد، چه درسهایی میتوانیم بگیریم؟ نکتهی اصلی مطمئنا این نیست که راسل دولیتل مقالهای را اشتباه خوانده است، چون هر کسی ممکن است این کار را بکند. دانشمندان بهطورکلی برای توانایی نوشتن به صورت روشن و واضح شناخته نمیشوند و مقالهی بوگ و همکاران(a1996) هم از این قاعده مستثنا نیست. درس اصلی این است که پیچیدگیکاهشناپذیر مشکلی جدیتر از آنچه داروینیستها تا امروز به آن اعتراف کردهاند، به نظر میآید. زیرا آزمایشی که دولیتل خود انتخاب کرد تا نشان دهد «موسیقی و هماهنگی میتواند از ارکستر کوچکتر نیز به وجود آید» دقیقا خلاف آنچه را انتظار میرود، نشان داد. درس دوم این است که تکثیر ژنی راه حلی نیست که بهطور عام برای حل مشکل تکامل مطرح میشود. پروفسور دولیتل همچنان که همگی با ساختارهای پروتیینی انعقاد خون و ژنهای آنها آشنا هستند، معتقد است بسیاری از آنها به واسطهی تکثیر ژنی و جابهجایی اگزونها[۵۷] به وجود آمدهاند. با این حال، دانش او از ارایهی جهش یافتههای کاملا ناموفق به عنوان نمونههایی برای واسطههای تکاملی[۵۸] جلوگیری نکرد. درس سوم این است که -همانطور که در کتاب جعبه سیاه داروین ادعا کردهام- در ادبیات علمی هیچ مقالهای وجود ندارد که جزییات نحوهی پیدایش مسیر انقعاد خون را به وسیلهی روشهای داروینی مطرح کند. اگر چنین مقالاتی موجود بودند، دولیتل به راحتی به آنها ارجاع میداد.
یک درس مهم دیگر که میتوانیم بگیریم، این است که در حالی که اکثر زیستشناسان و فیلسوفهای دانشگاهی به داروینیسم اعتماد دارند، این اعتماد بر پایهی اساسهایی معتبرتر از اساسهای پروفسور دولیتل نیست. برای تصور بهتر، بیایید نقدهای فیلسوف، مایکل روس[۵۹] را در نظر بگیریم:
به عنوان مثال، بیهی دانشمندی واقعی است اما دلیل او برای عدم امکان پدید آمدن طبیعی مرحله به مرحلهی پیچیدگی بیولوژیکی را دانشمندانی که در این زمینه فعالیت میکنند، به شکلی تحقیرآمیز به چالش کشیدهاند. آنها فکر میکنند که درک او از علوم مربوط به این موضوع ضعیف است و دانش او از متون علمی به طرز عجیب و غریبی (اگرچه به صورت مناسبی برای خودش) منسوخ شده است. به عنوان مثال، فارغ از اینکه ماهیت تکامل انعقاد خون یک راز باشد، در سه دههی گذشته کارهای راسل دولیتل و دیگران، روشهایی را که خونریزی به وجود آمده است به طرزی واضح نشان داده است. بیش از این، میتوان نشان داد که مکانیسم انعقاد خون حتما نباید یک پدیدهی تک مرحلهای باشد که همه چیز به جای خود وجود دارد و در حال کارکردن است. یکی از مراحل در زنجیره شامل فیبرینوژن است که برای لخته شدن خون لازم است و دیگری پلامینوژن که برای تخلیهی لختهها لازم است. (روس، ۱۹۹۸)
او در ادامه قسمتی از مقالهی دولیتل را از بوستون ریویو که پیشتر خاطر نشان کردم، نقل میکند. مایکل روس دانشمند داروینی برجستهای است که کتابهای زیادی در زمینههای مختلف داروینیسم نوشته است. اما همانطور که نقل قول او از استدلال اشتباه دولیتل نشان میدهد، دانش مستقلی از اینکه نخستین گامهای انتخاب طبیعی چهگونه میتواند سیستمهای زیستشناختی پیچیده را تشکیل دهد، ندارد. در جنبههای مورد بحث علمی، روس چیز جدیدی اضافه نمیکند.
یک مثال مشابه دیگر، مقالهای با عنوان طراحی نه چندان هوشمندانه، نوشتهی نیل اس. گرینسپن[۶۰]، استاد پاتولوژی در دانشگاه کیس وسترن ریزرو[۶۱]، است. او در مقالهی خود (گرینسپن ۲۰۰۲) مینویسد: «طرفداران طراحیهوشمندانه نیز از نمونههای فزایندهی کاهشپذیری سیستمهای بیولوژیکی غافل میمانند. همانطور که راسل دولیتل در نقدهای خود به نوشتههای یکی از دفاعکنندگان از طراحیهوشمندانه مینویسد . . .» و به این ترتیب گرینسپن به تایید استدلال دولیتل در مجلهی بوستون ریویو میپردازد. او با کنایهای ناخواسته به این نتیجه میرسد که «این نتایج بر ادعاهای طرفداران طراحیهوشمندانه نسبت به اینکه کدام سیستمهای پیچیده ویژگی کاهشناپذیری را نمایش میدهند و کدام نه، شک و شبهه میافکند.» اما از آنجا که نتایج مقالهی بوگ و همکاران (۱۹۹۶ا) دقیقا عکس ادعاهایی هستند که گرینسپن فرض میکند، اکنون ادعاهای داروینیستها، چه در زمینهی زیستشناسی و چه بر بستر فلسفی، در مورد اینکه سیستمهای سلولی پیچیده با اصطلاحات داروینی قابل توضیح هستند، به شدت مورد تردید قرار میگیرد. این واقعه نشان میدهد که داروینیستها یا نمیتوانند مشکلات نظریهشان را تشخیص دهند یا اصرار دارند که این مشکلات را تشخیص ندهند.
تلهموش
دومین دیدگاه مقابل باکاهشناپذیری که در اینجا بحث خواهم کرد، مربوط به نمونهای زیستشناختی نیست بلکه مثالی مفهومی است. در جعبه سیاه داروین، من به یک تلهموش مکانیکی رایج به عنوان یک نمونه از پیچیدگیکاهشناپذیر اشاره کردهام. تقریبا بلافاصله پس از انتشار، برخی داروینیستها شروع به پیشنهاد راههایی برای ساخت گام به گام تلهموش کردند. یکی از طرحهای پیشنهادی که توجه زیادی را به خود جلب کرد و برخی دانشمندان برجسته هم آن را تایید کردند، متعلق به جان مکدونالد[۶۲]، استاد زیستشناسی در دانشگاه دلاور[۶۳] است. این طرح را میتوانید در وبسایت او ببینید[۴]. مجموعه تلههای او در شکل ۳ نشان داده شده است. نکتهی اصلی مکدونالد این بود که تلهای که من در کتاب خود به نمایش در آورده بودم، از پنج قطعه تشکیل شده بود اما او میتوانست با قطعات کمتر یک تله بسازد. من موافقم. در واقع، من دقیقا همین چیز را در کتاب خود نوشتهام:
ما باید میان پیشنیاز فیزیکی و پیشنیاز مفهومی تمایز قایل شویم. تلهای که در بالا توصیف شد، تنها سیستمی نیست که میتواند یک موش را ناتوان کند. در موارد دیگر، خانوادهی من از تلهچسب استفاده کرده است. حداقل در باب تئوری، میتوان از یک جعبهی باز شده با یک چوب استفاده کرد، یا میتوانید به سادگی با تفنگ بادی به موش شلیک کنید. با این حال، اینها پیشنیازهای فیزیکی برای یک تلهموش استاندارد نیستند زیرا نمیتوانند به صورت گام به گام به یک تلهموش با پایه، چکش، فنر، قفل و میلهی نگهدارنده تبدیل شوند. (بیهی ۱۹۹۶، ۴۳)
بنابراین، مسئله این نیست که تلهموش میتواند به روشهای مختلف و با تعداد مختلفی از قطعاتی متفاوت ساخته شود. فرزندان من یک بازی به نام «تلهموش» دارند که شامل تعداد زیادی قطعه است و بهطورکلی با آنچه یک تلهموش مکانیکی معمولی به نظر میآید متفاوت است. سوال تنها این است که آیا یک تلهموش خاص میتواند با «تغییرات متعدد، متوالی و کوچک» در یک نقطه شروع ساده -بدون مداخلهی هوش- ساخته شود، همانطور که داروین اصرار داشت؟ این چیزی است که تئوری او نیاز دارد.
تلههای مکدونالد این امکان را ایجاد نمیکنند. در بالای شکل ۳، تلهی یک قطعهای و تلهی دو قطعهای او نمایش داده شده است اما ساختار تلهی دوم به هیچوجه یک فاصلهی کوچک و تصادفی از تلهی اول نیست. ابتدا توجه کنید که تلهی یک قطعهای، یک فنر فشرده شدهی ساده نیست و به شکلی بسیار خاص طراحی شده است. در واقع، این شکل را عاملی هوشمند (جان مکدونالد) عمدا انتخاب کرده است تا به عنوان یک تله عمل کند. خوب، باید از جایی شروع کرد. اما اگر سری تلههای موجود به تکامل داروینی ارتباطی داشته باشند، پس هیچ هوشی نباید در هیچ مرحلهی دیگری درگیر باشد.
اما هوشمندی در تمام مراحل نفوذ میکند. فکر کنید چه چیزی برای تبدیل تلهی یک قطعهای به تلهی «دو قطعهای» لازم است. نمیتوانید فقط تلهی اول را روی یک تکه چوب ساده قرار دهید و انتظار داشته باشید که همانند تلهی دوم عمل کند. به عبارت دیگر، همانطور که در شکل ۳ مشاهده میکنید، برای تبدیل تلهی یک قطعهای به تلهی دو قطعهای، نیاز به تغییر اولیهای در دو انتهای بیرونآمده از فنر دارید. افزون بر این، دو مهرهی کوچک (که به سختی قابل مشاهدهاند) برای نگهداشتن این دو انتها به آن اضافه میشوند تا فنر در تلهی دو قطعهای در حالت کششی قرار گیرد. بنابراین، ما از یک تلهی یک قطعهای به یک تلهی چهار قطعهای رفتهایم، نه از یک تلهی یک قطعهای به تلهی دو قطعهای. توجه داشته باشید که مکان قرارگیری مهرهها نسبت به لبهی تخته بسیار حیاتی است. اگر مهرهها یک چهارم اینچ از جایی که هستند جابهجا میشدند، تله کار نمیکرد. در نهایت، در نظر داشته باشید که برای داشتن یک تشبیه جدی به فرایندهای ماشینی سلول، نمیتوانیم یک انسان باهوش را داشته باشیم که تله را تنظیم کند. تلهی اول باید با یک مکانیسم شارژ ناخودآگاه تنظیم شود. در نتیجه، هنگامی که قطعات مرتب شدهاند، مکانیسم شارژ برای تلهی دو قطعهای نیز باید تغییر کند.
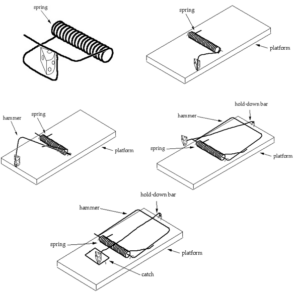
شکل ۳- مجموعهای از تلهموشها با تعداد بیشتری از قطعات، همانند پیشنهاد جان مکدونالد
برای ما انسانهای هوشمند، آسان است که نقش خود در هدایت ساخت یک سیستم فراموش کنیم اما طبیعت نمیتواند هیچ گامی را از یاد ببرد. بنابراین، مجموعه تلهموشهای مکدونالد به عنوان مقایسهای برای تکامل داروینی بهطور کامل شکست میخورد. در واقع، بهترین نگاه به تلهی دوم به عنوان نسل داروینی تلهی اول نیست بلکه باید به آن به عنوان تلهی کاملا متفاوتی که عاملی هوشمند طراحی کرده نگاه کنیم. این تله احتمالا تلهای است که با استفاده از یک یا دو قطعه از تلهی اول، مجددا طراحی شده است. هر یک از مراحل بعدی این مجموعه با مشکلات مشابهی روبهرو است که من در جاهای دیگر دربارهی آنها بحث کردهام.[۵]
در تایید تلهموشهای مکدونالد، کنث میلر مینویسد: «اگر نسخههای سادهتر از این دستگاه مکانیکی (تلهموش) میتوانند عمل کنند، آنگاه نسخههای سادهتری از ماشینهای بیولوژیکی نیز میتوانند عمل کنند . . . و این بدین معنا است که ماشینهای بیولوژیکی پیچیده ممکن است پیششکلهای عملی داشته باشند»[۶]. اگر میلر با «پیششکل» به «پیششکل داروینی» اشاره میکند، این دقیقا همان چیزی است که این موضوع آن را نشان نمیدهد. برعکس، سری تلهموش مکدونالد نشان میدهد که حتی اگر سیستم سادهتری را برای انجام عملیاتی پیدا کنیم، این ما را به این فکر نمیاندازد که سیستم پیچیدهتر میتوانسته با فرایندی داروینی از سیستم سادهتر ساخته شده باشد بلکه، دشواری انجام این کار برای یک تلهی ساده به ما دلیل قابل قبولی میدهد تا فکر کنیم که این امر برای ماشینهای مولکولی پیچیده نیز انجام نمیشود.
دورنمای آیندهی فرضیهی طراحیهوشمندانه
استدلالهای اشتباه داروینیستها که من در اینجا برشمردم، مرا دلگرم میکنند که فرضیهی طراحی هوشمند در مسیر درست قرار دارد. بههرحال، اگر مخالفان باهوش یک ایده با استفاده از دادههایی به آن حمله کنند که- اگر به صورت عینی نگریسته شود- درواقع قوت آن را نشان میدهد، آنگاه شخص باید مطمئن باشد که آن ایده ارزش بررسی دارد.
اما نابسندگی پاسخهای داروینیستی نیست که بهنفع فرضیهی طراحی کار میکند؛ بلکه قوت طراحی عمدتا از پیشرفت مداوم علم حاصل میشود. برای درک این واقعیت باید بدانیم که ایدهی طراحی هوشمند نه از کار یک فرد، بلکه از مجموع کار زیستشناسی، بهخصوص در پنجاه سال گذشته، برخاسته است. پنجاه سال پیش، سلول بسیار سادهتر بهنظر میرسید و ما بهدلیل سادگی و بیتجربگی در آن زمان فکر میکردیم که فرایندهای داروینی میتواند آن را تبیین کند. اما وقتی با پیشرفت زیستشناسی، سادگی مذکور ناپدید شد، ایدهی طراحی هرچهبیشتر قانعکننده شد. این روند با همان شدت ادامه دارد. سلول سادهتر نمیشود، بلکه بسیار پیچیدهتر میشود. من این فصل را با نقل تنها یک مثال از حوزهی نسبتا جدید پروتئومیک[۶۴] بهپایان میبرم.
با زنجیرهسازی موفقیتآمیز تمام ژنومهای موجودات ذرهبینی و یک مهرهدار (خودمان)، انگیزهها بهسمت تحلیل تعاملات سلولی پروتیینهایی که ژنومها برای آنها رمزگذاری میکند- بهعنوان یک کل- چرخیده و تاکنون پیشرفت زیادی حاصل شده است. در اوایل سال ۲۰۰۲، مطالعهای جامع دربارهی پروتیینهای سازندهی پروتئوم[۶۵] مخمر انجام شد. یکی از سوالاتی که محققان پرسیده بودند، این بود که چه نسبتی از پروتیینهای مخمر به صورت گروهی کار میکنند. آنها کشف کردند که تقریبا پنجاهدرصد پروتیینها به صورت مجموعههایی از نیمجین یا بیشتر و بسیاری از آنها به صورت مجموعههای دهتایی یا بیشتر کار میکنند (گوین[۶۶] و همکاران، ۲۰۰۲).
این اصلا آن چیزی نیست که داروینیستها انتظار داشتند. همانطور که بروس اَلبرتس[۶۷] پیشتر در مقالهی سلول بهعنوان مجموعهای از ماشینهای پروتیینی نوشت:
«ما همیشه سلولها را دستکم گرفتهایم. بدون شک، امروز هم همان کار را میکنیم. اما حداقل دیگر به بیتجربگی وقتی که من در دههی ۱۹۶۰ دانشجوی تحصیلات تکمیلی بودم، نیستیم. آن زمان، اکثر ما سلولها را چیزی تصور میکردیم که شامل مجموعهی عظیمی از واکنشهای مرتبهدوم بود . .
اما آنطور که فهمیدیم، میتوانیم راه برویم و صحبت کنیم، زیرا شیمی حیات بسیار ظریفتر و پیچیدهتر از چیزی است که ما دانشجویان تصور میکردیم. پروتیینها بیشتر جرم خشک سلول را تشکیل میدهند. اما اکنون میدانیم که بهجای یک سلول که مولکولهای پروتیینی تکی -که به صورت تصادفی باهم برخورد میکنند- بر آن حاکماند، تقریبا هر فرایند عمدهای در سلول از طریق تشکیلاتی شامل ده پروتیین یا بیشتر انجام میشود. هریک از این تشکیلات پروتیینی درعین عملکردهای زیستی خودش، با چند مجموعهی بزرگتر پروتیینی تعامل دارد. کل سلول را میتوان کارخانهای دانست که شامل شبکهای ظریف از خطوط تشکیلاتی پیوسته است که هریک از این خطوط از یک مجموعه ماشینهای پروتیینی بزرگ تشکیل شده است. (اَلبرتس، ۱۹۹۸)
در اینجا، نکتهی مهم برای نظریهی طراحی هوشمند این است که ماشینهای مولکولی به مثالهای اندکی که من در جعبهی سیاه داروین مطرح کردم، محدود نمیشود. درواقع، اکثر پروتیینها به صورت مولفههای ماشینهای مولکولی پیچیده یافت میشوند. بنابراین، طراحی ممکن است شامل تعداد زیادی از ویژگیهای سلول باشد و شاید فراتر از آن، تا سطوح بالاتر زیستشناسی گسترش یابد.
پیشرفت علم در قرن بیستم ما را به فرضیهی طراحی رهنمون شد. من انتظار دارم که پیشرفتهای قرن بیستویکم این فرضیه را تایید کند و گسترش دهد.
منبع:
Debating Design: From Darwin to DNA, William A. Dembski & Michael Ruse, Cambridge University Press, 2004, pp. 352-370
یادداشتها:
۱- برای مثال، جیمز شپیرو[۶۸]، استاد میکروبیولوژی در دانشگاه شیکاگو، در مجلهی نشنال ریویو[۶۹] اعلام کرد که هیچ تبیین داروینی جامعی برای تکامل سیستمهای سلولی یا بیوشیمیایی وجود ندارد و تنها گمانهزنیهای امیدوارانه دیده میشود“ (شپیرو، ۱۹۹۶: ۶۵). جری کُینی[۷۰]، زیستشناس تکاملی دانشگاه شیکاگو، در مجلهی نیچر[۷۱] نوشت که ”هیچ شکی نیست که مسیرهای توصیفشده ازسوی بیهی بهشکل ترسناکی پیچیدهاند، و تایید تکامل آنها دشوار خواهد بود… شاید تا ابد نتوانیم اولین مسیرهای ابتدایی را کشف کنیم“ (کُینی، ۱۹۹۶: ۲۲۷). اما تام کاوالیر اسمیت[۷۲]، زیستشناس تکاملی در دانشگاه بریتیش کلمبیا، در نقدی تند در مجلهی روندها در بومشناسی و تکامل[۷۳] نوشت، «هنوز برای هیچیک از مواردی که بیهی ذکر میکند، تبیین مفصل و جامعی دربارهی گامهای احتمالی در تکامل پیچیدگی وجود ندارد. این مسائل کاملا نادیده گرفته شده بودند، اگرچه بیهی مکررا این غفلت را با کلماتی مانند «سکوت کامل و عجیب» بزرگ جلوه میدهد» (کاوالیر اسمیت، ۱۹۹۷: ۱۶۲). بهگفتهی اندرو پومیانکوسکی[۷۴]، زیستشناس تکاملی، در مقالهای در مجلهی نیوساینتیست[۷۵]، «هر کتاب درسی بیوشیمی که بردارید، شاید تنها دو یا سه ارجاع به تکامل در آن بیابید. به یکی از این ارجاعات نگاه کنید و اگر چیزی بهتر از «تکامل مناسبترین مولکولها را برای عملکرد زیستیشان انتخاب میکند» یافتید، شانس زیادی آوردهاید» (پومیانکوسکی، ۱۹۹۶: ۴۴). رابرت دوریت[۷۶]، زیستشناس مولکولی دانشگاه ییل در امریکن ساینتیست[۷۷] با قطعیت بیان کرد که «بهمعنی دقیق، وقتی بیهی میگوید که ما هنوز تکامل موتور تاژکی یا زنجیرهی انعقاد خون را کامل نمیفهمیم، حق با او است.» (دوریت، ۱۹۹۷: ۴۷۴).
۲- مثال خوبی در پایگاه اینترنتی دنیای ریچارد داوکینز -که ازسوی یکی از طرفدارانش به نام جان کاتالانو[۷۸] بهنشانی www.world-of-dawkins.com/Catalano/box/published.htm اداره میشود- وجود دارد. پیتر اتکینز[۷۹]، شیمیفیزیکدان دانشگاه آکسفُرد، وقتی نقدی بر جعبهی سیاه داروین را برای پایگاه اینترنتی اینفیدلز[۸۰] مینوشت، به این پایگاه اینترنتی ارجاع داد: «دکتر بیهی ادعا میکند که علم عمدتا دربارهی جزئیات تکامل مولکولی، ظهور فرایندها و مسیرهای بیوشیمیایی پیچیده که زیربنای عادیترین جلوههای تکامل در سطح موجوداتند، ساکت است. مزخرف است! صدها و شاید هزاران مقالهی علمی وجود دارد که دقیقا به همین موضوع میپردازند. برای ورود به این حوزهی مهم و شکوفا و درک تلاشهای علمی گستردهای که نشاندهندهی آن است، (مراجعه کنید به اولین لینک بالا)» (اتکینز، ۱۹۹۸).
۳- باگی و همکاران (1996a) به این پرسش علاقهمند بودند که آیا پلاسمینوژن، غیر از نقشش در انعقاد خون، نقشی در متابولیسم ندارد؟ این واقعیت که پیامدهای مستقیم کمبود پلاسمینوژن از طریق کمبود فیبرینوژن بهبود مییابند، نشان میدهد که پلاسمینوژن احتمالا هیچ نقش دیگری ندارد.
۴- http://udel.edu/∼mcdonald/oldmousetrap.html. پرفسور مکدانلد اخیرا چند تلهموش جدید طراحی کرده است که میتوان آنها را در http://udel.edu/∼mcdonald/mousetrap.html دید. من آنها را بررسی کردم و نتیجه گرفتم که آنها نیز به همان اندازه شامل هوش هدایتگرند.
۵- ام. جِی. بیهی، دفاع از تلهموش: پاسخ به منتقدان. www.crsc.org
۶- http://biocrs.biomed.brown.edu/Darwin/DI/Mousetrap.html
منابع مقاله:
Aizawa, S. I. Flagellar 1996. Assembly in Salmonella Typhimurium. Molecular Microbiology ۱۹: ۱-۵.
Alberts, B. 1998. The cell as a collection of protein machines: preparing the next generation of molecular biologists. Cell ۹۲: ۲۹۱-۲۹۴.
Atkins, P. W. 1998. Review of Michael Behe’s Darwin’s Black Box. www.infidels.org/library/modern/peter_atkins/behe.html
Behe, M. J. 1996. Darwin’s black box :the biochemical challenge to evolution. New York: The Free Press. 2001. Reply to my critics: A response to reviews of Darwin’s Black Box: the biochemical challenge to evolution. Biology and Philosophy ۱۶: ۶۸۵-۷۰۹.
Bugge, T. H., Flick, M. J., Daugherty, C. C., & Degen, J. L. 1995. Plasminogen deficiency causes severe thrombosis but is compatible with development and reproduction. Genes and Development ۹: ۷۹۴-۸۰۷.
Irreducible Complexity
Bugge, T. H., Kombrinck, K. W., Flick, M. J., Daugherty, C. C., Danton, M. J., & Degen, J. L. 1996a. Loss of fibrinogen rescues mice from the pleiotropic effects of plasminogen deficiency. Cell ۸۷: ۷۰۹-۷۱۹.
Bugge, T. H., Xiao, Q., Kombrinck, K. W., Flick, M. J., Holmback, K., Danton, M. J.,
Colbert, M. C., Witte, D. P., Fujikawa, K., Davie, E. W., & Degen, J. L. 1996b. Fatal embryonic bleeding events in mice lacking tissue factor, the cell- associated initiator of blood coagulation. Proceedings of the National Academy of Sciences
of the United States of America ۹۳: ۶۲۵۸-۶۲۶۳.
Cavalier-Smith, T. 1997. The blind biochemist. Trends in Ecology and Evolution ۱۲: ۱۶۲-۱۶۳.
Coyne, J. A. 1996. God in the details. Nature ۳۸۳: ۲۲۷-۲۲۸.
Darwin, C. 1859. The origin of species. New York: Bantam Books.
Dawkins, R. 1986. The blind watchmaker. New York: Norton.
DeRosier, D. J. 1998. The turn of the screw: the bacterial flagellar motor. Cell ۹۳: ۱۷-۲۰.
Doolittle, R. F. A delicate balance. Boston Review Feb/March 1997, pp. 28-29.
Dorit, R. 1997. Molecular evolution and scientific inquiry, misperceived. American Scientist ۸۵: ۴۷۴-۴۷۵.
Dutcher, S. K. 1995. Flagellar assembly in two hundred and fifty easy-to-follow steps. Trends in Genetics ۱۱: ۳۹۸-۴۰۴.
Gavin, A. C., et al. 2002. Functional organization of the yeast proteome by systematic analysis of protein complexes. Nature ۴۱۵: ۱۴۱-۱۴۷.
Greenspan, N. S. 2002. Not-So-Intelligent Design. The Scientist ۱۶: ۱۲.
Halkier, T. 1992. Mechanisms in blood coagulation fibrinolysis and the complement system. Cambridge: Cambridge University Press.
Harold, F. M. 2001. The Way of the Cell. Oxford: Oxford University Press.
Hueck, C. J. 1998. Type III Protein Secretion Systems in Bacterial Pathogens of Animals and Plants. Microbiology and Molecular Biology Reviews ۶۲: ۳۷۹-۴۳۳.
Kauffman, S. A. 1995. At home in the universe :the search for laws of self-organization and complexity. New York: Oxford University Press.
Miller, K. R. 1999. Finding Darwin’s God: a scientist’s search for common ground between God and evolution. New York: Cliff Street Books.
Pomiankowski, A. The God of the tiny gaps. New Scientist Sept 14, 1996, pp. 44-45.
Ruse, M. Answering the creationists: Where they go wrong and what they’re afraid of. Free Inquiry March 22, 1998, p. 28.
Shapiro, J. In the details … what? National Review Sept 16, 1996, pp. 62-65.
Shapiro, L. 1995. The bacterial flagellum: from genetic network to complex architecture. Cell ۸۰: ۵۲۵-۵۲۷.
Suh, T. T., Holmback, K., Jensen, N. J., Daugherty, C. C., Small, K., Simon, D. I., Potter, S., & Degen, J. L. 1995. Resolution of spontaneous bleeding events but failure of pregnancy in fibrinogen-deficient mice. Genes and Development ۹: ۲۰۲۰-۲۰۳۳.
Sun, W. Y., Witte, D. P., Degen, J. L., Colbert, M. C., Burkart, M. C., Holmback, K., Xiao, Q., Bugge, T. H., & Degen, S.J. 1998. Prothrombin deficiency results in embryonic and neonatal lethality in mice. Proceedings of the National Academy of Sciences of the United States of America ۹۵: ۷۵۹۷-۷۶۰۲.
Yonekura, K., Maki, S., Morgan, D. G., DeRosier, D. J., Vonderviszt, F., Imada, K., & Michael J. Behe
Namba, K. 2000. The bacterial flagellar cap as the rotary promoter of flagellin selfassembly. Science ۲۹۰: ۲۱۴۸-۲۱۵۲.
[۱] Intelligent design
[۲] Charles Darwin
[۳] The Origin of Species
[۴] Evolution Theory
[۵] Natural Selection
[۶] Protoplasm
[۷] DNA (Deoxyribonucleic acid)
[۸] Genetic code
[۹] Darwin’s Black Box: The iochemical Challenge to Evolution (Behe 1996)
[۱۰] Irreducibly Complex
[۱۱] Eukaryotic Cilium
[۱۲] Bacterial Flagellum
[۱۳] DeRosier 1998; Shapiro 1995
[۱۴] Propeller
[۱۵] Hook Region
[۱۶] Universal Joint
[۱۷] Drive Shaft
[۱۸] Stator Structure
[۱۹] Bushing
[۲۰] Homologous
[۲۱] The Way of the Cell
[۲۲] Oxford University Press
[۲۳] Colorado State University
[۲۴] Franklin Harold
[۲۵] Richard Dawkins
[۲۶] Kenneth Miller
[۲۷] (Kauffman 1995, viii)
[۲۸] eukaryotic cilium
[۲۹] Dutcher
[۳۰] microtubules
[۳۱] dynein arms
[۳۲] John McDonald
[۳۳] Rotary propulsion device (Wankel engine)
[۳۴] Type three secretion system
[۳۵] Hueck, C.J. Type III secretion systems in bacterial pathogens of animals and plants. Microbiol. Mol. Biol. Rev. 62, 379-433
[۳۶] Blood clotting cascade
[۳۷] Halkier
[۳۸] Fibrin
[۳۹] Fibrinogen
[۴۰] Plasmin
[۴۱] Thrombin
[۴۲] Prothrombin
[۴۳] Stuart factor
[۴۴] Tissue factor
[۴۵] Nonspecific enzyme
[۴۶] Substrate
[۴۷]Russell Doolittle
[۴۸] UCSD
[۴۹] Climbing Mount Improbable
[۵۰] Boston Review
[۵۱] Bugge
[۵۲] Pleiotropy
[۵۳] Plasminogen
[۵۴] Loss of fibrinogen rescues mice from the pleiotropic effects of plasminogen deficiency
[۵۵] Hemorrhage
[۵۶] Thrombosis
[۵۷] Exon shuffling
[۵۸] Evolutionary Intermediates
[۵۹] Michael Ruse
[۶۰] Neil S. Greenspan
[۶۱] Case Western Reserve University (CWRU)
[۶۲] John McDonald
[۶۳] University of Delaware
[۶۴] Proteomics، بررسی ساختار و عملکرد پروتیینها در مقیاس بزرگ.
[۶۵] proteome
[۶۶] Gavin
[۶۷] Bruce Alberts
[۶۸] James Shapiro
[۶۹] National Review
[۷۰] Jerry Coyne
[۷۱] Nature
[۷۲] Tom Cavalier-Smith
[۷۳] Trends in Ecology and Evolution
[۷۴] Andrew Pomiankowski
[۷۵] New Scientist
[۷۶] Robert Dorit
[۷۷] American Scientist
[۷۸] John Catalano
[۷۹] Peter Atkins
[۸۰] Infidels




